2021年CDE受理1439个药品申报,中药创新高、生物制品势头强劲
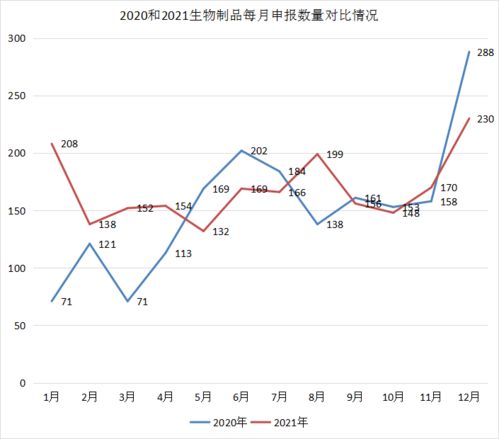
2021年,国家药品监督管理局药品审评中心(CDE)共受理药品注册申请1439个,这一数据反映了我国医药行业的创新活力与政策引导成效。其中,中药申报数量创下历史新高,生物制品领域亦展现出强劲的发展势头,共同构成了年度药品审评的亮点。
一、总体受理情况:创新药占比提升,审评效率持续优化
2021年CDE受理的1439个药品注册申请中,创新药和改良型新药占比显著提高,体现了我国从“仿制为主”向“创新驱动”的战略转型。CDE通过优先审评、突破性治疗药物程序等机制,加速了临床急需和具有明显临床价值的药品上市。同时,审评流程的数字化、标准化建设进一步提升了效率,为企业和研发机构提供了更加明确和可预期的审评环境。
二、中药申报数量创新高:政策红利释放,研发热情高涨
2021年,中药注册申报数量达到近年峰值,这主要得益于多项支持中医药发展的政策落地。例如,《中药注册分类及申报资料要求》的实施,明确了中药创新药、改良型新药、经典名方等分类,简化了申报流程,激发了企业的研发积极性。新冠疫情中中医药的广泛应用,也提升了市场对中药价值的认可,促使更多企业投入中药新药研发。经典名方制剂、中药复方制剂以及源于古代经典名方的中药新药成为申报热点,展现了中药现代化与标准化进程的加速。
三、生物制品领域:创新突破频现,研发管线丰富
生物制品作为医药创新的前沿领域,在2021年表现尤为突出。CDE受理的生物制品申请覆盖了单克隆抗体、细胞治疗、基因治疗、疫苗等多个细分领域。其中,肿瘤免疫治疗药物(如PD-1/PD-L1抑制剂)持续领跑,CAR-T细胞治疗等前沿技术亦有多项申请进入审评阶段。新冠疫情推动疫苗研发加速,多款mRNA疫苗、重组蛋白疫苗等新型疫苗申报,彰显了我国生物制药技术的快速进步。生物类似药的申报数量稳步增长,显示出国内企业在生物药研发与产业化方面的成熟度提升。
四、趋势展望:中药与生物制品或成未来增长双引擎
综合2021年数据,中药与生物制品已成为我国药品研发的两大增长点。中药在政策扶持与市场需求双重驱动下,有望在慢性病管理、抗病毒等领域实现更大突破;生物制品则凭借技术迭代与临床优势,将持续引领创新药发展。未来,CDE或进一步优化审评策略,鼓励中西医结合、生物技术与传统医药融合的创新路径,为全球医药贡献更多“中国方案”。
2021年CDE受理数据的亮眼表现,不仅是我国医药创新能力的体现,更是政策环境、市场需求与技术积累共同作用的结果。中药申报创新高与生物制品的蓬勃发展,预示着我国医药产业正迈向更加多元化、高质量的创新阶段。
如若转载,请注明出处:http://www.hzll88.com/product/10.html
更新时间:2026-02-24 00:34:34